1. 국내 의료기기 인허가 제도의 개요
국내 의료기기의 인허가 제도에 대하여 알아보기로 한다.
기본적인 개념을 먼저 보면 1등급 의료기기는 제조·수입 신고, 2등급은 제조·수입 인증 또는 허가, 3~4등급은 제조·수입 허가로 다루어진다. 보통 모든 등급을 허가라고 표현하지만 세부적으로 절차 자체가 다르므로 이해가 필요하다고 사료된다.
통상적으로 1등급은 GMP 인증을 받을 필요가 없고(허가 대상은 제외), 2등급부터는 GMP 인증을 받아야 하며, 기술문서 심사 완료 이후 식약처(MFDS)에 제조·수입 인증 또는 허가를 신청하기 위해서는 ‘GMP 적합 인정서’를 첨부하여야 한다.
지금부터 의료기기의 정의를 시작으로 등급 분류의 판단기준과 신고, 인증, 허가 절차에 대하여 알아보기로 한다. 또한 각각의 비용과 수수료 정보는 「의료기기법 시행규칙」 〔별표8〕 붙임 7 및 〔별표10〕을 참조하기 바란다.
2. 의료기기 및 용어의 정의
(1) 의료기기
“의료기기”란 사람이나 동물에게 단독 또는 조합하여 사용되는 기구ㆍ기계ㆍ장치ㆍ재료ㆍ소프트웨어 또는 이와 유사한 제품으로서 다음 각 호의 어느 하나에 해당하는 제품을 말한다. 다만, 「약사법」에 따른 의약품과 의약외품 및 「장애인복지법」 제65조에 따른 장애인보조기구 중 의지(義肢)ㆍ보조기(補助器)는 제외한다.
1) 질병을 진단ㆍ치료ㆍ경감ㆍ처치 또는 예방할 목적으로 사용되는 제품
2) 상해(傷害) 또는 장애를 진단ㆍ치료ㆍ경감 또는 보정할 목적으로 사용되는 제품
3) 구조 또는 기능을 검사ㆍ대체 또는 변형할 목적으로 사용되는 제품
4) 임신을 조절할 목적으로 사용되는 제품
(2) 용어의 정의
| 새로운 제품 | 이미 허가·인증을 받은 의료기기와 사용목적, 작용원리 또는 원재료(의료기기에 한정)등이 동등하지 아니한 의료기기 |
| 개량제품 | 이미 허가·인증을 받은 의료기기와 사용목적, 작용원리, 원재료(의료기기에 한정)는 동등하나, 성능, 시험규격, 사용방법 등이 동등하지 아니한 의료기기 |
| 동등제품 | 이미 허가·인증을 받은 의료기기와 사용목적, 작용원리, 원재료(의료기기에 한정)는 동등한 의료기기 |
| 동등공고제품 | 2등급 의료기기 중 동등제품으로 3회 이상 허가, 인증받은 제품에 대하여 사용목적, 작용원리, 원재료, 성능, 시험규격 및 사용방법 등이 동등한 의료기기로 식약처장이 별도로 공고한 제품 |
3. 의료기기의 등급분류 및 기준
(1) 의료기기의 등급분류
1) 1등급 : 잠재적 위해성이 거의 없는 의료기기
2) 2등급 : 잠재적 위해성이 낮은 의료기기
3) 3등급 : 중등도의 잠재적 위해성을 가진 의료기기
4) 4등급 : 고도의 위해성을 가진 의료기기
(2) 의료기기의 등급분류의 예시
1) 1등급 : 비멸균 주사침, 일회용 산소 투여용 튜브, 지혈대, 압박용 밴드 등
2) 2등급 : 혈관 내 튜브 및 카테터, 의안, CT, MRI, 초음파, PACS(의료영상전 송장치) 소프트웨어 등
3) 3등급 : 치과용 임플란트, 투석기, 인공뼈, 인공호흡기, 심장충격기, 콘돔 등
4) 4등급 : 심장·중추신경계·중앙혈관계 등에 직접 접촉하여 사용되는 의료기기 인체 내에 영구적으로 이식되는 의료기기 (인공각막, 필러 등) ※ 보톡스 – 의약품에 속한다.
(3) 잠재적 위해성에 대한 판단 기준
1) 인체와 접촉하고 있는 기간
2) 침습의 정도
3) 약품이나 에너지를 환자에게 전달하는지 여부
4) 환자에게 생물학적 영향을 미치는지 여부
※ 「의료기기 품목 및 품목별 등급에 관한 규정」 〔별표1〕 및 「의료기기법 시행규칙」 〔별표1〕 참고하여 대상 의료기기의 품목 분류 및 등급 확인 가능
※ 식약처의 의료기기정책과에 의료기기 해당여부 질의를 통해 의료기기 여부, 품목명, 등급 확인이 가능하다.
(4) 자체적으로 의료기기의 품목 분류 및 등급 판단이 어려운 경우
1)의료기기전자민원시스템에 민원 신청으로 답변 획득 가능하다.
2) 단, 의료기기의 판단을 원했으나 개인용 건강관리제품으로 답변받을 수 있는 등, 한 번 답변을 받으면 되돌리기 어려우므로 무조건적인 질의는 주의해야 한다.
3) 따라서 국내 판매되고 있는 타사 제품에 대해 조사하여 의료기기전자민원시스템의 ‘업체/제품정보 공개’에서 확인한다.
4) 타사 제품의 등록 정보 확인하여 품목명, 등급 등의 정보를 활용한다.
4. 등급에 따른 신고·인증·허가 절차
(1) 1등급 의료기기 제조 신고절차

1) 의료기기전자민원시스템 ‘1등급 의료기기 민원신청’에서 ‘번호1. 의료기기 제조신고’ 및 수수료 납부
2) 민원인 안내서에 따라 관련 구비서류 작성 후 제출
3) 한국의료기기안전정보원(NIDS)에서 검토(필요시 보완) 및 1등급 의료기기 신고 완료
(2) 2등급 의료기기 제조 인증·허가 절차
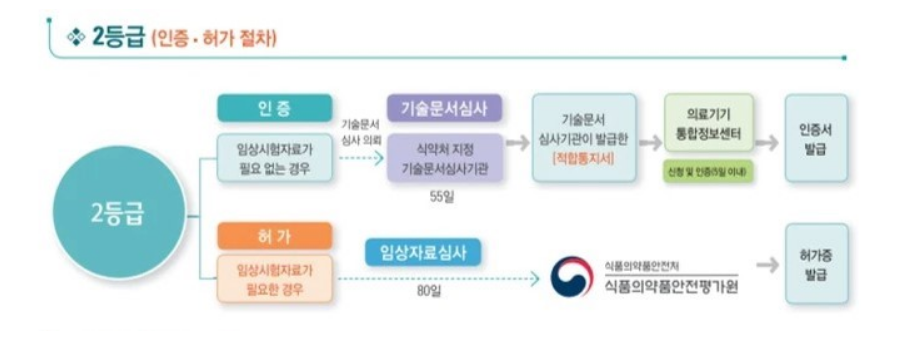
1) 2등급 의료기기 제조 인증절차
가. 식약처 지정 기술문서심사기관(7개 기관)에 기술문서 심사 의뢰 및 상담
나. 의료기기전자민원시스템 ‘전자민원안내 및 신청’에서 ‘번호11. 2등급의료기기 기술문서심사’ 신청 및 수수료 납부
다. 심사 보완 사항 처리 및 기술문서 심사 완료
라. 의료기기전자민원시스템 ‘의료기기제조인증’신청 (신청서 및 GMP 적합인정서 등 첨부자료 제출) 및 수수료 납부
마. 한국의료기기안전정보원(NIDS) 검토(필요시 보완처리) 및 제조 인증 완료 (수리)
2) 2등급 의료기기 제조 허가절차
가. 의료기기전자민원시스템 ‘전자민원안내 및 신청’에서 ‘번호37 의료기기기술문서등의 심사(임상자료심사)’ 신청서 작성 및 첨부자료 제출
나. 수수료 납부 후 식약처 검토
다. 보완처리 완료 및 기술문서 심사 완료
라. 의료기기전자민원시스템 ‘의료기기제조허가’신청 (신청서 및 GMP 적합인정서 등 첨부자료 제출) 및 수수료 납부
마. 식약처 검토 (필요시 보완처리) 및 제조 허가 완료(수리)
※ GMP(Good Manufacturing Practice)(의료기기 제조 및 품질관리기준)
- 항상 일관된 양질의 제품이 공급될 수 있도록 의료기기의 개발에서부터 원자재구입, 제조, 검사, 포장, 설치, 보관, 출하 클레임이나 반품에 이르기까지의 모든 공정에 걸쳐 의료기기의 품질을 보증하기 위하여 지켜야 할 사항을 규정하는 품질경영시스템을 말한다.
(3) 3~4등급 의료기기 제조 허가절차
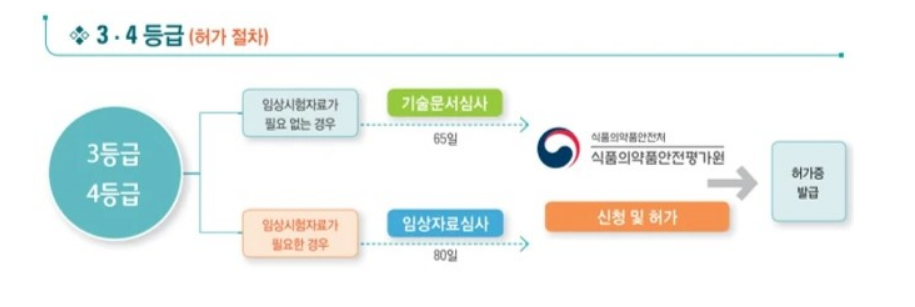
1) 의료기기전자민원시스템 ‘전자민원안내 및 신청’에서 ‘번호21 의료기기제조 허가(기술문서심사)’ 또는 해당시 ‘의료기기제조허가(임상자료심사)’신청
2) 수수료 납부 후 식약처 검토
3) 보완처리 완료 및 기술문서 심사 완료
4) 의료기기전자민원시스템 ‘의료기기제조허가’신청 (신청서 및 GMP 적합인정서 등 첨부자료 제출) 및 수수료 납부
5) 식약처 검토 (필요시 보완처리) 및 제조 허가 완료(수리)
5. 의료기기 등급별 신고, 인증, 허가 대상의 분류
(1) 등급별 구분
| 등급 | 대상 | 비고 | |
| 1등급 | 신고 | 대부분 제품 | - |
| 허가 | 기 신고제품과 다른 전혀 새로운 제품 | GMP 인증 필요 |
|
| 2등급 | 인증 | 대부분 제품(개량제품, 동등제품, 동등공고제품) | |
| 허가 | 기 인증제품과 다른 전혀 새로운 제품 | ||
| 2등급 중 지정된 의료기기 의약품/의약외품과 조합되거나 복합 구성된 의료기기 유헬스케어 의료기기, 호흡감시기 매일착용 하드/소프트 콘텍트랜즈 의료기기 허가·신의료기술평가 통합운영 대상 의료기기 |
|||
| 3~4 등급 | 허가 | 모든 3~4등급 제품 | |
(2) 인허가 대상별 구분
| 대상 | 등급 | 비고 |
| 신고대상 | 대부분 1등급 의료기기 | - |
| 인증대상 | 대부분 2등급 의료기기 (개량제품,동등제품,동등공고제품) | - |
| 허가대상 | 3~4등급 의료기기 | 임상시험 대상 가능성 있음 |
| 1등급 및 2등급 의료기기 중 신고/인증 제품과 다른 새로운 제품 | ||
| 2등급 중 지정된 의료기기 의약품/의약외품과 조합되거나 복합 구성된 의료기기 유헬스케어 의료기기, 호흡감시기 매일착용 하드/소프트 콘텍트랜즈 의료기기 허가·신의료기술평가 통합운영 대상 의료기기 |
(3) 인허가 절차 및 처리기간
| 구분 | 기술문서 심사 | 인허가 | 처리기관 | ||
| 신고 | 대부분 1등급 제품 | - | 즉시 | 한국의료기기안전정보원 | |
| 인증 | 2등급 중 | 동등공고제품 | - | 5일 이내 | 한국의료기기안전정보원 |
| 동등/개량제품 | 25일 이내 | 5일 이내 | 한국의료기기안전정보원 | ||
| 허가 | 1~4등급 중 | 임상시험 불필요 | 55일 이내 | 10일 이내 | 식약처 |
| 임상시험 대상 | 70일 이내 | 10일 이내 | 식약처 | ||
| - 인증대상 기술문서 심사는 식약처가 지정한 기술문서심사기관에서 진행(KTL, KTR 등) - 허가대상 기술문서와 인허가는 통합심사 가능(55일 이내 +10일 이내 → 65일 이내) |
|||||